Angélique LAMAZE ,
Former Fyssen, 2011-2012
Article publié dans Nature,
Scientific Reports 7, Article number: 40304 (2017)
Depuis les années 2000, la mouche du vinaigre Drosophila melanogaster est utilisée pour comprendre les modalités génétiques et cellulaires régulant le sommeil.
Dormir est primordial pour tout organisme possédant un système nerveux central. Cependant, lorsque l’on dort on diminue sa perception de ce qui nous entoure. Par exemple, alors que des vibrations mécaniques provoquent une augmentation de la locomotion chez la drosophile, cette même intensité vibratoire ne provoque pas de réponse locomotrice si l’animal est en train de dormir. Le fait que nos perceptions diminuent pendant le sommeil nous rend plus vulnérable vis a vis d’une menace éventuelle.
Il est donc important pour l’organisme de définir le moment opportun pour s’endormir. La mouche du vinaigre est comme tous les insectes un animal poïkilotherme, sa température interne dépend de la température externe. Par conséquent, son sommeil est très sensible à la température extérieure. La drosophile male présente deux phases de sommeil. Elle fait ce que l’on appelle dans le jargon scientifique une “sieste” le jour et dort de façon plus profonde la nuit. L’augmentation de température modifie cette architecture du sommeil.

Dans cet article nous montrons qu’en condition une température ≥30°C déplace la phase de la sieste
(les mouches s’endorment plus tard mais aussi se réveillent plus tard) et perturbe le sommeil la nuit (les mouches ont du mal a s’endormir et se réveillent plus tôt).
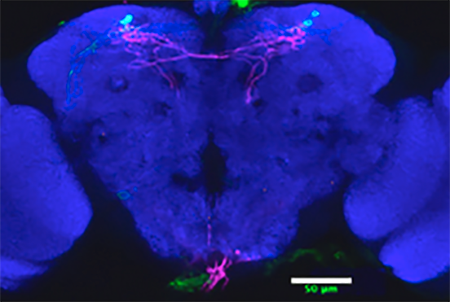
Nous montrons que le retard à l’endormissement utilise différents circuits neuronaux entre le jour et la nuit.
Nous montrons que le jour deux groupes de neurones sensoriels exprimant le récepteur thermique dTrpA1 sont nécessaires au délai de l’initiation de la sieste en réponse à une température chaude.
De plus, nous montrons que ces neurones contactent directement un groupe de neurones d’horloge dans le cerveau, les DN1p, dont a été défini auparavant une fonction sur l’activité locomotrice le matin.
Pour finir, nous montrons que l’activité de ces neurones d’horloge est nécessaire pour moduler l’initiation de la sieste en réponse à une température chaude.
Angélique Lamaze est une drosophiliste spécialisée dans le fonctionnement et les différents rôles de l’horloge circadienne chez Drosophila melanogaster. Elle est actuellement chercheur contractuel au sein de l’institut de neurologie à l’ UCL de Londres. Après avoir obtenu le diplôme de Magistère de génétique de l’Université Paris VII en 2006 (aujourd’hui appelé Magistère Européen de Génétique), elle a effectué sa thèse dans l’unique laboratoire français spécialisé dans l’étude de l’horloge circadienne chez Drosophila melanogaster, dirigé par le Dr. François Rouyer à l’Institut Alfred Fessard à Gif-sur-Yvette (aujourd’hui rebaptisé Institut des Neurosciences Paris-Saclay). En 2011, elle a intégré le laboratoire du Dr. Kyunghee Koh à l’Université T. Jefferson de Philadelphie, lauréate d’une bourse Fyssen de deux ans. En collaboration avec le laboratoire du Dr. Mark Wu à l’Université Johns Hopkins de Baltimore, ils ont mis en évidence un nouveau gène jouant un rôle dans l’initiation du sommeil chez la drosophile.
Elle a rejoint le Dr James Jepson (avec qui elle avait déjà travaillé à Philadelphie) à Londres en septembre 2014. Ils ont récemment publié un travail décrivant un circuit neuronal mettant en évidence l’intégration entre information environnementale et temporelle par le cerveau pour moduler l’initiation de la sieste chez Drosophila melanogaster. »


